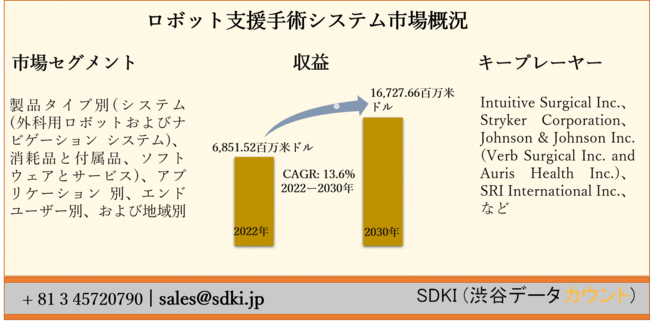
CYBERDYNE株式会社(本社:茨城県つくば市、代表取締役社長:山海嘉之)は、新たに開発した医療用HAL下肢タイプ(以下、「医療用HAL」)の小型モデルについて、日本における既承認の適用疾患に対する医療機器として、PMDA(独立行政法人医薬品医療機器総合機構)に製造販売承認申請を提出したことを発表しました。

今回の小型モデルは、既承認機器である医療用 HALを使用できない小柄な患者も使用可能な小型機器になっています。この機器の開発にあたっては、一部、AMED(国立研究開発法人日本医療研究開発機構)からの支援をうけています。
本承認申請により、これまでサイズが合わないために医療用HALを利用できなかった小柄な患者に対して、医療用HALによる治療機会を拡大するための大きな一歩を踏み出すことが期待されます。今後は、PMDAによる審査が円滑に進められるよう、情報提出等に努め、また、欧州、米国、アジアなどの諸外国でも医療機器申請を順次進めていくとしています。
既承認の適用疾患について
神経筋難病(8疾患)
脊髄性筋萎縮症(SMA)、球脊髄性筋萎縮症(SBMA)、筋萎縮性側索硬化症(ALS)、シャルコー・マリー・トゥース病(CMT)、遠位型ミオパチー、封入体筋炎(IBM)、先天性ミオパチー、筋ジストロフィー
脊髄疾患(2疾患)
HTLV-1関連脊髄症(HAM)、遺伝性痙性対麻痺
AMED(国立研究開発法人日本医療研究開発機構)からの支援について
AMEDの2019〜2023年度「医療機器開発推進研究事業・小児用医療機器の実用化を目指す 医師主導治験・臨床研究等」での、研究課題「脳性麻痺等の発達期非進行性運動機能障害児に対する身体運動機能の向上を目指した小児用下肢装着型治療ロボットの開発と検証的医師主導治験(代表研究者:筑波大学・丸島愛樹医師)」にて、現在治験実施中です。治験実施中の小児用下肢装着型治療ロボットは、本発表の対象品と同等機器です。